Hidratarea și Steatoza Hepatică
O analiză completă
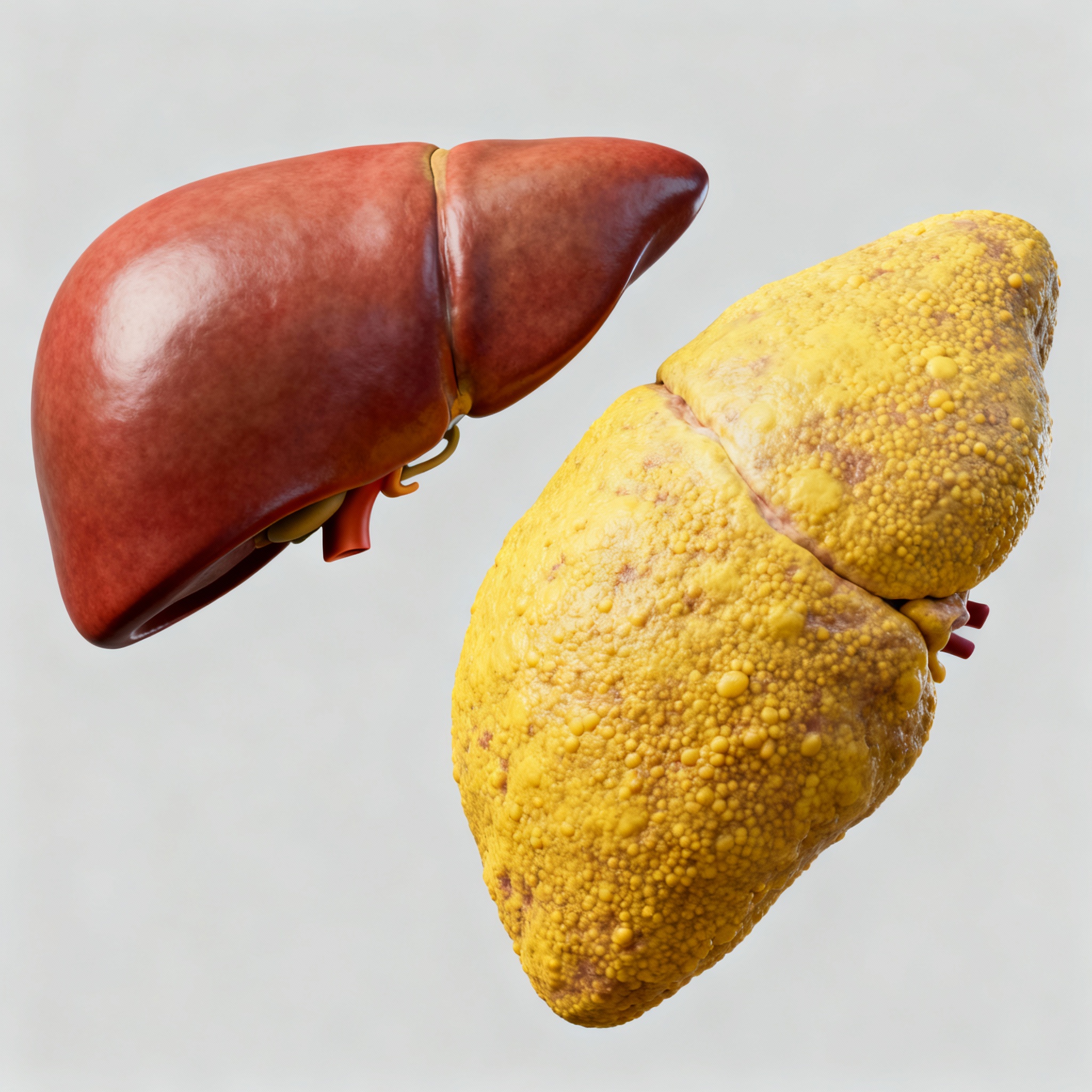
Contextul steatozei hepatice
Boala hepatică steatozică asociată disfuncției metabolice (MASLD), cunoscută anterior ca NAFLD, este o afecțiune hepatică prevalentă, caracterizată prin acumularea excesivă de grăsime în ficat, neasociată cu consumul excesiv de alcool. Factorii de risc majori includ obezitatea, diabetul de tip 2, dislipidemia și sindromul metabolic. Având în vedere rolul fundamental al apei în procesele metabolice, detoxifiere și menținerea homeostaziei organismului, s-a speculat o legătură semnificativă între aportul de apă și riscul de MASLD/NAFLD.
Dovezi științifice actuale
1. Aportul de apă și riscul de MASLD/NAFLD
Un studiu populațional amplu, desfășurat în China între 2010 și 2019, a investigat relația dintre aportul de apă plată (PWI) și riscul de MASLD/NAFLD nou diagnosticată. Studiul, care a inclus 16.434 de participanți, a relevat că un aport mai mare de apă plată a fost asociat independent cu un risc mai scăzut de MASLD/NAFLD la bărbați, dar nu și la femei. Bărbații care consumau 4-7 căni/zi sau >7 căni/zi de apă plată au prezentat un risc semnificativ mai mic de MASLD/NAFLD comparativ cu cei care consumau ≤3 căni/zi [1, 2]. Autorii sugerează că un aport adecvat de apă poate contribui la reducerea greutății corporale, a aportului caloric total și la creșterea oxidării grăsimilor și a consumului de energie, toți acești factori fiind strâns legați de tulburările metabolice care favorizează apariția MASLD/NAFLD.

2. Aportul de apă și mortalitatea la pacienții cu MASLD/NAFLD
Un studiu recent din 2024 a analizat asocierea dintre aportul de apă plată și riscul de mortalitate de toate cauzele și de cauze specifice la persoanele cu MASLD/NAFLD. Rezultatele au indicat că un aport mai mare de apă plată a fost legat independent de un risc mai scăzut de mortalitate de toate cauzele, mortalitate prin boli cerebrovasculare și mortalitate prin cancer la pacienții cu MASLD/NAFLD. De asemenea, înlocuirea băuturilor zaharoase sau artificiale cu apă plată a fost asociată cu o reducere a mortalității. Studiul concluzionează că creșterea aportului de apă plată poate fi o strategie eficientă pentru acești pacienți în vederea reducerii riscului de mortalitate [3].
3. Biomarkeri de deshidratare și ficat gras
Cercetările au evidențiat o legătură între statusul suboptimal de hidratare și MASLD. Un studiu NHANES 2017–2020 pe adulți a arătat că o osmolalitate serică mai mare (indicator al hidratării suboptimale) s-a asociat liniar cu șanse mai mari de MASLD, chiar și după ajustări extinse [4]. Mecanismul propus implică creșterea osmolalității, care duce la creșterea vasopresinei, asociată cu o acumulare mai mare de grăsime intrahepatică și inflamație specifică steatohepatitei non-alcoolice (NASH).
4. Copeptina și MASLD/NAFLD
Copeptina, un marker stabil al vasopresinei, a fost investigată în relație cu MASLD/NAFLD. La pacienții obezi cu biopsie hepatică, nivelele crescute de copeptină au fost independent asociate cu prezența și severitatea MASLD/NAFLD, corelând și cu steatoza macro/microveziculară și inflamația lobulară [5]. Rezultate similare au fost observate și în populații generale, unde nivelele mai mari de copeptină au fost asociate cu un risc crescut de MASLD/NAFLD după ajustări [6].
5. Impactul hidratării suboptimale la copii și adolescenți
Un studiu de cohortă pediatrică recent, publicat în 2023, a sugerat că statusul suboptimal de hidratare crește riscul incident de MASLD la copii și adolescenți. Acest studiu subliniază rolul critic al aportului de apă și al statusului optim de hidratare pentru sănătatea hepatică la această categorie de vârstă [7].

6. Mecanisme potențiale și intervenții
Deși studiile indică o corelație puternică, mecanismele exacte prin care aportul de apă influențează MASLD/NAFLD necesită investigații suplimentare. Ipotezele și dovezile preclinice și intermediare includ:
- Detoxifiere și funcție hepatică: Apa este esențială pentru funcționarea optimă a ficatului, facilitând fluidizarea sângelui și eliminarea toxinelor. O hidratare adecvată susține procesele metabolice hepatice și poate preveni acumularea de substanțe nocive [8, 9]. Deshidratarea poate reduce perfuzia hepatică, compromite detoxifierea și poate duce la creșterea enzimelor hepatice (ALT, AST, fosfataza alcalină) [10, 11].
- Controlul greutății: Consumul de apă poate induce senzația de sațietate, reducând aportul caloric general și, implicit, riscul de obezitate, un factor major de risc pentru MASLD/NAFLD [1, 12].
- Metabolismul zahărului: Deshidratarea poate afecta metabolismul glucozei și sensibilitatea la insulină, factori care contribuie la dezvoltarea MASLD/NAFLD. Un aport adecvat de apă poate ajuta la menținerea echilibrului glicemic.
- Evitarea băuturilor dăunătoare: Înlocuirea băuturilor îndulcite cu zahăr sau artificiale cu apă plată este un factor crucial, deoarece aceste băuturi au fost asociate cu un risc crescut de MASLD/NAFLD [3, 13]. În modele experimentale, fructoza (inclusiv prin activarea căii poliol → fructoză endogenă în condiții de osmolalitate crescută) stimulează vasopresina și favorizează sindromul metabolic și steatoza; apa contrabalansează aceste efecte [14].
- Intervenții preclinice: La rozătoare, creșterea aportului de apă (ceea ce duce la o vasopresină mai mică) reduce steatoza hepatică chiar și fără scădere ponderală, iar blocarea căii vasopresinei atenuează fenotipul metabolic [15].
- Apa îmbogățită cu hidrogen: O meta-analiză din 2024, incluzând 8 studii randomizate controlate cu 433 de participanți, a demonstrat că apa îmbogățită cu hidrogen poate reduce ușor nivelurile enzimelor hepatice ALT, AST și ALP la populațiile clinice [16, 17].
7. Efectele hidratării asupra rigidității hepatice
Un studiu din 2021 a demonstrat că un consum de apă afectează direct rigiditatea ficatului și hemodinamica hepatică. Valorile parametrilor de rigiditate hepatică (SWV) au crescut semnificativ la 30-45 de minute după consumul de apă și s-au normalizat după 60 de minute. Acest lucru sugerează că hidratarea poate influența temporar măsurătorile elastografice ale ficatului [18].
8. Ritmurile circadiene și cronometrarea hidratării
Cercetările recente din 2023 indică faptul că ficatul posedă un ceas circadian propriu, care reglează aproximativ 40% din transcriptomul hepatic. Acest ceas hepatic este puternic influențat de momentul consumului de hrană și, implicit, de hidratare [19, 20]. Cu toate acestea, nu există dovezi solide că un moment specific al zilei pentru consumul de apă (ex. dimineața vs. seara) influențează independent riscul de steatoză. Beneficiul pare să fie legat de statusul global de hidratare și de înlocuirea băuturilor zaharoase cu apă, nu de ora exactă a consumului [21].
Mecanisme fiziopatologice detaliate
Legătura dintre consumul de apă și steatoza hepatică este susținută de o serie de mecanisme fiziopatologice complexe, care implică atât efecte sistemice, cât și procese moleculare specifice la nivel hepatic. Elaborarea acestor mecanisme este esențială pentru a înțelege cum un gest simplu, precum menținerea unei hidratări adecvate, poate influența o boală metabolică complexă.
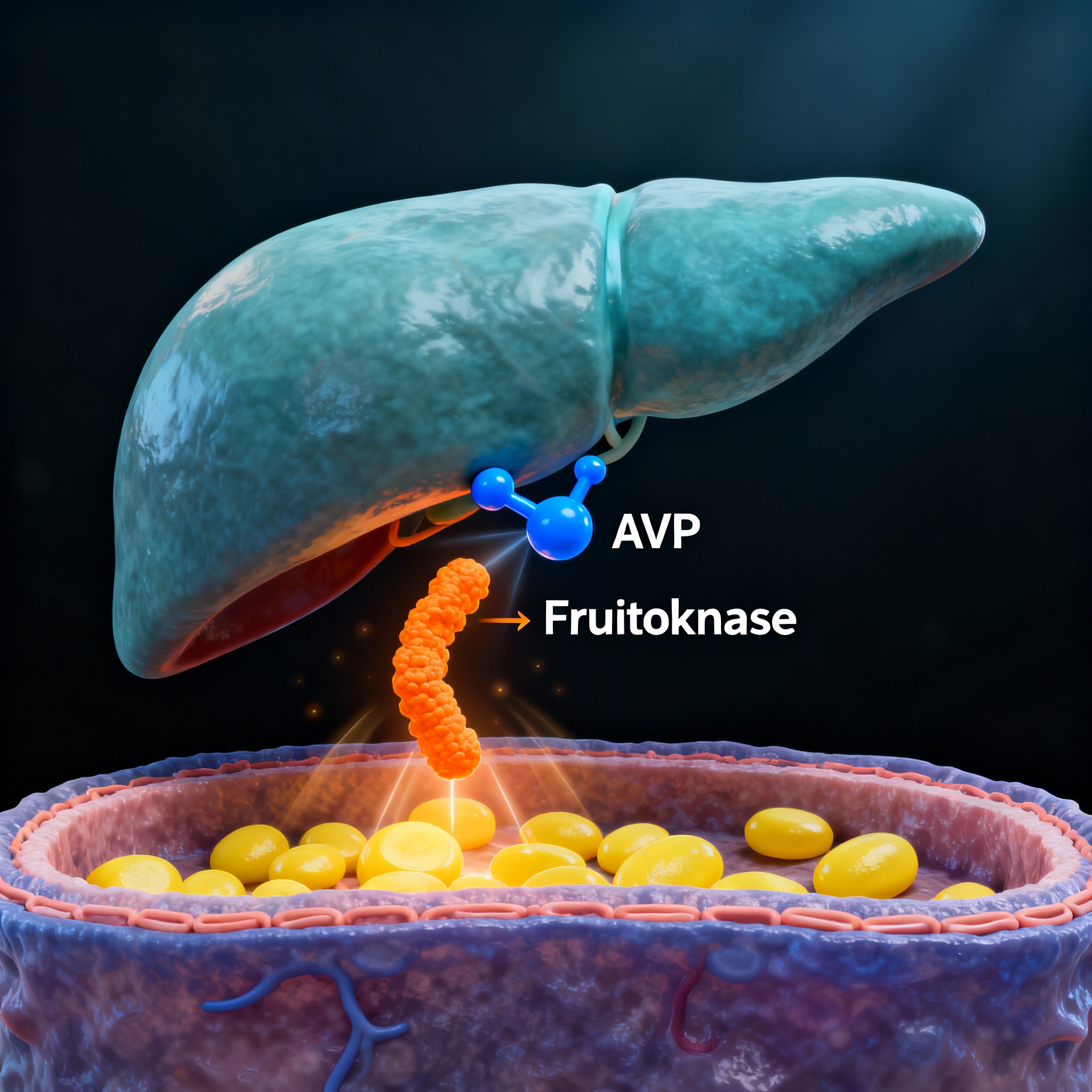
1. Calea vasopresină-fructokinază: un mecanism central
Cel mai bine documentat mecanism leagă deshidratarea de acumularea de grăsime în ficat prin intermediul axei hormonale a vasopresinei.
- Activarea vasopresinei: Starea de deshidratare, chiar și una ușoară și cronică, duce la o creștere a osmolalității serice (concentrația de particule dizolvate în sânge). Această modificare este detectată de hipotalamus, care comandă eliberarea de arginin-vasopresină (AVP), un hormon antidiuretic. Nivelurile crescute de AVP sunt reflectate clinic de niveluri ridicate de copeptină, un marker mai stabil [4, 5].
- Acțiunea hepatică a vasopresinei: Vasopresina acționează asupra ficatului prin intermediul a doi receptori principali: V1aR și V1bR. Studiile au arătat că AVP, prin activarea receptorului V1bR, joacă un rol crucial în medierea efectelor metabolice negative induse de fructoză [14]. Activarea acestor receptori stimulează direct producția hepatică de glucoză (glicogenoliză) și poate altera semnalizarea insulinei [25].
- Rolul fructozei endogene: Un aspect fascinant este că vasopresina stimulează o cale metabolică prin care organismul își produce propria fructoză în ficat, pornind de la glucoză (calea poliol). Acest proces este exacerbat nu doar de deshidratare, ci și de un aport ridicat de sare sau de fructoză din dietă. Fructoza, fie că este produsă endogen sau consumată, este apoi metabolizată în ficat de enzima fructokinază (sau ketohexokinază).
- Consecințele metabolice: Metabolizarea rapidă a fructozei de către fructokinază duce la o depleție tranzitorie de ATP (molecula de energie a celulei) și la producția de acid uric. Aceste modificări declanșează o cascadă de evenimente negative: stres oxidativ la nivel mitocondrial, inflamație și, cel mai important, o stimulare puternică a lipogenezei de novo – procesul prin care ficatul produce noi acizi grași, care sunt apoi stocați sub formă de trigliceride, ducând la steatoză [14, 26].
Pe scurt: Deshidratarea → Creșterea vasopresinei → Activarea fructokinazei hepatice → Producție de fructoză endogenă și metabolizare rapidă → Stres oxidativ și inflamație → Stimularea producției de grăsime în ficat (lipogeneza de novo).

2. Efecte metabolice și hemodinamice generale
Pe lângă calea specifică a vasopresinei, hidratarea influențează metabolismul hepatic și sistemic prin mecanisme mai generale, dar la fel de importante.
- Termogeneza indusă de apă: Consumul de apă, în special apă rece, a fost demonstrat că induce o creștere a ratei metabolice, un fenomen cunoscut sub numele de termogeneză indusă de apă. Acest efect, deși modest, poate contribui la un consum energetic total mai mare pe parcursul zilei și la o mai bună oxidare a grăsimilor, contracarând astfel acumularea de lipide [1].
- Controlul aportului caloric: Apa joacă un rol mecanic în controlul greutății. Consumul de apă înainte de mese crește senzația de sațietate, ceea ce poate duce la un aport caloric redus. Prin reducerea riscului de obezitate, se reduce și unul dintre principalii factori de risc pentru MASLD [12, 23].
- Optimizarea perfuziei hepatice: O hidratare adecvată asigură un volum sanguin optim și o vâscozitate normală a sângelui. Acest lucru este crucial pentru o perfuzie (irigare cu sânge) eficientă a ficatului. O perfuzie adecvată garantează un aport corespunzător de oxigen și nutrienți și, la fel de important, o eliminare eficientă a toxinelor și a produșilor de metabolism. Deshidratarea cronică poate compromite acest flux, supunând ficatul unui stres suplimentar [10].
3. Impactul asupra homeostaziei celulare și a stresului oxidativ
La nivel celular, statusul de hidratare influențează direct funcționarea hepatocitelor (celulele hepatice).
- Menținerea volumului celular: Celulele hepatice funcționează optim într-un interval specific de volum. Deshidratarea poate duce la micșorarea volumului celular, un semnal catabolic care poate promova degradarea proteinelor și glicogenului. În contrast, hidratarea celulară acționează ca un semnal anabolic, favorizând sinteza de proteine și glicogen și inhibând procesele catabolice.
- Modularea stresului oxidativ: Așa cum s-a menționat, calea vasopresină-fructokinază este o sursă majoră de stres oxidativ. Prin menținerea unor niveluri scăzute de vasopresină, o hidratare adecvată poate reduce indirect producția de specii reactive de oxigen la nivel mitocondrial, protejând astfel hepatocitele de daunele oxidative care contribuie la progresia de la steatoză simplă la steatohepatită (NASH).
- Rolul autophagy: Autophagy este un proces celular esențial de curățare și reciclare a componentelor celulare. Disfuncția autophagy a fost implicată în patogeneza MASLD. O hidratare optimă poate susține funcția autophagy, contribuind la eliminarea lipidelor acumulate și la menținerea sănătății hepatice.
4. Influența asupra microbiomului intestinal
Deși nu este un mecanism direct hepatic, hidratarea adecvată joacă un rol crucial în menținerea unui microbiom intestinal sănătos. Un microbiom disbiotic (dezechilibrat) poate contribui la progresia MASLD prin creșterea permeabilității intestinale, translocarea de produse bacteriene (ex. endotoxine) către ficat și alterarea metabolismului acizilor biliari. O hidratare optimă poate susține integritatea barierei intestinale și echilibrul microbiomului, reducând astfel inflamația hepatică și acumularea de grăsime.
5. Apa îmbogățită cu hidrogen
O meta-analiză din 2024, incluzând 8 studii randomizate controlate cu 433 de participanți, a demonstrat că apa îmbogățită cu hidrogen poate reduce ușor nivelurile enzimelor hepatice ALT, AST și ALP la populațiile clinice [16, 17]. Mecanismele propuse includ proprietățile antioxidante și antiinflamatorii ale hidrogenului molecular.
Comparație: consumul de apă versus alți factori de stil de viață în steatoza hepatică
Deși consumul adecvat de apă este un factor important în prevenția și managementul MASLD/NAFLD, este esențial să se înțeleagă rolul său în contextul mai larg al factorilor de stil de viață, cum ar fi dieta și exercițiile fizice. Acești factori interacționează și contribuie sinergic la sănătatea hepatică.
1. Rolul dietei în MASLD/NAFLD
Dieta este considerată piatra de temelie în managementul MASLD/NAFLD. O dietă nesănătoasă, bogată în grăsimi saturate, zaharuri rafinate (în special fructoză) și calorii, este un factor major de risc pentru dezvoltarea și progresia steatozei hepatice [27, 28]. Mecanismele includ:
- Lipogeneza de novo: Consumul excesiv de carbohidrați, în special fructoză, stimulează sinteza de grăsimi în ficat, contribuind direct la acumularea de trigliceride [14, 29].
- Rezistența la insulină: Dietele bogate în calorii și zaharuri duc la rezistență la insulină, un factor cheie în patogeneza MASLD/NAFLD, care promovează acumularea de grăsime și inflamația hepatică [30].
- Inflamația și stresul oxidativ: Anumite componente dietetice pot induce inflamație sistemică și stres oxidativ, agravând leziunile hepatice [27].
Intervenții dietetice eficiente: Reducerea aportului caloric, adoptarea unei diete mediteraneene, reducerea consumului de fructoză și grăsimi saturate, și creșterea aportului de fibre și acizi grași omega-3 au demonstrat o reducere semnificativă a grăsimii hepatice și îmbunătățirea histologiei hepatice [28, 31].
2. Rolul exercițiilor fizice în MASLD/NAFLD
Activitatea fizică regulată este un alt pilon fundamental în prevenția și tratamentul MASLD/NAFLD, independent de pierderea în greutate. Beneficiile exercițiilor fizice includ [32, 33]:
- Reducerea grăsimii hepatice: Exercițiile fizice, în special cele de intensitate moderată spre înaltă, pot reduce direct conținutul de grăsime din ficat, chiar și în absența unei pierderi semnificative în greutate [34, 35].
- Îmbunătățirea sensibilității la insulină: Activitatea fizică crește sensibilitatea la insulină, ajutând la o mai bună gestionare a glucozei și la reducerea lipogenezei hepatice [33].
- Creșterea oxidării acizilor grași: Exercițiile stimulează arderea grăsimilor (oxidarea acizilor grași) la nivel hepatic și muscular, contribuind la reducerea acumulării de lipide [36].
- Efecte antiinflamatorii: Activitatea fizică are efecte antiinflamatorii și antioxidante, protejând ficatul de leziuni [32].
3. Interacțiunea și importanța relativă
Consumul de apă, dieta și exercițiile fizice nu sunt factori izolați, ci interacționează complex pentru a influența sănătatea hepatică. Deși aportul adecvat de apă are mecanisme specifice de acțiune (ex. modularea vasopresinei, controlul sațietății), impactul său este adesea complementar și potențat de o dietă sănătoasă și activitate fizică regulată.
| Factor de stil de viață | Mecanisme principale de acțiune | Impact direct asupra steatozei hepatice | Importanță relativă | Complementaritate cu apa |
|---|---|---|---|---|
| Consumul de apă | Modularea vasopresinei, controlul sațietății, detoxifiere, termogeneză, perfuzie hepatică | Moderat spre semnificativ (prevenție, mortalitate) | Foarte important, adesea subestimat | Sinergic: apa facilitează detoxifierea și controlul greutății, amplificând efectele dietei și exercițiilor. |
| Dieta sănătoasă | Reducerea aportului caloric, scăderea fructozei/grăsimilor, îmbunătățirea sensibilității la insulină, reducerea inflamației | Foarte semnificativ (reducerea grăsimii, îmbunătățirea histologiei) | Fundamental | Sinergic: apa poate reduce aportul caloric și înlocui băuturile dăunătoare, sprijinind obiectivele dietetice. |
| Exerciții fizice | Reducerea grăsimii hepatice, creșterea sensibilității la insulină, oxidarea acizilor grași, efecte antiinflamatorii | Semnificativ (reducerea grăsimii, îmbunătățirea sensibilității la insulină) | Esențial | Sinergic: hidratarea adecvată este crucială pentru performanța fizică și recuperare, maximizând beneficiile exercițiilor. |
Concluzie: Consumul adecvat de apă nu este un substitut pentru o dietă sănătoasă și exerciții fizice regulate, ci mai degrabă un component esențial al unui stil de viață holistic care contribuie la prevenția și managementul MASLD/NAFLD. Abordarea optimă implică o strategie integrată care include toți acești factori, recunoscând că fiecare joacă un rol distinct, dar interconectat, în menținerea sănătății hepatice.
Concluzii și implicații practice
Pe baza dovezilor științifice analizate, există o legătură validată și semnificativă între consumul adecvat de apă și un risc mai scăzut de steatoză hepatică (MASLD/NAFLD), în special la bărbați, precum și o reducere a mortalității la pacienții deja diagnosticați. Hidratarea deficitară, prin contrast, poate contribui indirect la apariția sau agravarea steatozei hepatice prin impactul său asupra metabolismului, controlului greutății și funcției de detoxifiere a ficatului.
Recomandări practice (bazate pe dovezi):
- Țintește o hidratare adecvată zilnic: Menținerea unei hidratări optime (indicată de urina deschisă la culoare) și evitarea hiperosmolalității cronice sunt esențiale. Datele asociative pe adulți și copii sugerează că deshidratarea ușoară persistentă este legată de MASLD [4, 7]. Necesarul zilnic optim este de minimum jumătate din greutatea corporală în uncii de apă zilnic, sau peste 4 căni (aproximativ 1 litru) pe zi pentru efecte protectoare [1, 22].
- Înlocuiește băuturile zaharoase cu apă: Există mecanisme și date (umane/animale) care indică beneficii metabolice și hepatice semnificative prin înlocuirea băuturilor cu fructoză sau îndulcite artificial cu apă [3, 14].
- Consumă apă înainte de mese: Un pahar de apă înainte de mese poate contribui la senzația de sațietate și la scăderea copeptinei, fiind o componentă rezonabilă a unei strategii metabolice, deși nu există încă studii randomizate controlate care să demonstreze o reducere directă a grăsimii hepatice prin această practică [23].
- Moderează aportul de sodiu: Sodiu ridicat poate crește osmolalitatea și activa calea poliol/fructoză endogenă; moderația la sare rămâne prudentă în context metabolic [24].

Limitări și direcții viitoare:
Deși studiile indică o corelație puternică, este nevoie de cercetări suplimentare pentru a stabili o relație cauzală directă și pentru a înțelege pe deplin mecanismele implicate, în special diferențele observate între sexe. Momentul specific al consumului de apă nu a fost validat ca factor independent în influențarea riscului de steatoză; ceea ce contează este totalul și constanța hidratării, precum și tipul de lichid consumat [21].
Recomandări clinice și implicații pentru sănătatea publică
Având în vedere dovezile tot mai consistente privind legătura dintre statusul de hidratare și steatoza hepatică, este imperativă integrarea acestor cunoștințe în practica clinică și în strategiile de sănătate publică.
Recomandări clinice:
- Evaluarea statusului de hidratare: Medicii ar trebui să includă o evaluare a aportului de lichide și a statusului de hidratare în anamneza pacienților cu risc de MASLD/NAFLD sau deja diagnosticați. Indicatori precum frecvența urinării, culoarea urinei și, în cazuri selecționate, osmolalitatea serică sau nivelurile de copeptină, pot oferi informații valoroase [4, 5].
- Consiliere nutrițională centrată pe hidratare: Pacienții cu MASLD/NAFLD ar trebui să primească consiliere specifică privind importanța unui aport adecvat de apă. Accentul trebuie pus pe înlocuirea băuturilor zaharoase și artificiale cu apă plată, având în vedere impactul negativ al acestora asupra sănătății hepatice și metabolică [3, 14, 13].
- Strategii de creștere a aportului de apă: Recomandările practice ar trebui să includă:
- Consumul regulat de apă pe parcursul zilei, nu doar la senzația de sete.
- Un pahar de apă înainte de mese pentru a contribui la sațietate și la controlul aportului caloric [23].
- Stabilirea unor obiective realiste de aport de apă, adaptate nevoilor individuale (ex. jumătate din greutatea corporală în uncii de apă zilnic) [1, 22].
- Atenție la interacțiuni: În cazul examinării rigidității hepatice prin elastografie, pacienții ar trebui instruiți să evite consumul de apă cu cel puțin o oră înainte de procedură, pentru a preveni rezultatele fals pozitive sau interpretările eronate [18].
Implicații pentru sănătatea publică:
- Campanii de conștientizare: Dezvoltarea și implementarea unor campanii de sănătate publică care să educe populația generală, și în special grupurile de risc, despre importanța hidratării adecvate în prevenția și managementul MASLD/NAFLD. Aceste campanii ar trebui să sublinieze beneficiile apei ca alternativă sănătoasă la băuturile îndulcite.
- Politici alimentare: Susținerea politicilor care promovează accesul la apă potabilă sigură și gratuită în spațiile publice, școli și locurile de muncă. Descurajarea consumului de băuturi zaharoase prin taxe sau reglementări poate avea un impact pozitiv asupra sănătății hepatice la nivel populațional.
- Cercetare suplimentară: Continuarea finanțării și încurajarea cercetărilor prospective, randomizate și controlate, pentru a elucida pe deplin relațiile cauzale, mecanismele moleculare și diferențele de gen în răspunsul la intervențiile legate de hidratare. Studiile pe termen lung sunt necesare pentru a evalua impactul intervențiilor asupra progresiei bolii și a rezultatelor clinice.
- Educație medicală continuă: Includerea informațiilor actualizate despre hidratare și sănătatea hepatică în programele de educație medicală continuă pentru profesioniștii din sănătate, asigurându-se că aceștia sunt la curent cu cele mai recente dovezi și recomandări.
Prin adoptarea unei abordări integrate, care combină recomandările clinice individualizate cu strategii de sănătate publică, se poate contribui semnificativ la reducerea prevalenței și a impactului MASLD/NAFLD, o problemă de sănătate publică în creștere la nivel global.

Referințe
- [1] Wang, X., Lin, S., Gan, S., et al. (2021). Higher plain water intake is related to lower newly diagnosed nonalcoholic fatty liver disease risk: a population-based study. European Journal of Clinical Nutrition, 75(12), 1801-1808. https://pubmed.ncbi.nlm.nih.gov/33837275/
- [2] Wang, X., Lin, S., Gan, S., et al. (2021). Higher plain water intake is related to lower newly diagnosed nonalcoholic fatty liver disease risk: a population-based study. Nature, 75, 1801–1808. https://www.nature.com/articles/s41430-021-00891-9
- [3] Zhao, N., He, Y., Li, Y., et al. (2024). Association of plain water intake with risk of all-cause and cause-specific mortality in individuals with non-alcoholic fatty liver disease or metabolic dysfunction-associated steatotic liver disease. Frontiers in Nutrition, 11, 1478194. https://www.frontiersin.org/journals/nutrition/articles/10.3389/fnut.2024.1478194/full
- [4] Peng, L., & Ai, M. (2025). Association of serum osmolality with metabolic dysfunction-associated steatotic liver disease in adults. BMC Gastroenterology, 25(1), 693. https://link.springer.com/article/10.1186/s12876-025-04309-9
- [5] Aydin, S., et al. (2019). Elevated plasma copeptin levels identify the presence and severity of non-alcoholic fatty liver disease in obesity. BMC Medicine, 17(1), 77. https://bmcmedicine.biomedcentral.com/articles/10.1186/s12916-019-1319-4
- [6] Oosthuizen, W., et al. (2019). Copeptin relates to a fatty liver and measures of obesity in a South African population with mixed ethnicities. PMC, 6656785. https://pmc.ncbi.nlm.nih.gov/articles/PMC6656785/
- [7] Long, M., Xiao, H., Ashaei, Y., et al. (2023). Suboptimal hydration status increases the risk of incident MASLD: A pediatric cohort study. Journal of Hepatology. https://www.journal-of-hepatology.eu/article/S0168-8278(23)05292-3/abstract
- [8] Beneficiile apei asupra detoxifierii ficatului. (2014). Sfatul Medicului. https://www.sfatulmedicului.ro/Ficatul-si-caile-biliare/beneficiile-apei-asupra-detoxifierii-ficatului_13474
- [9] 6 Tips for Keeping Your Liver Healthy. (2024). Bay Gastroenterology. https://www.baygastro.com/post/6-tips-for-keeping-your-liver-healthy
- [10] Zheng, S., et al. (2021). Effects of environmental contaminants in water resources on nonalcoholic fatty liver disease. ScienceDirect, S016041202100180X. https://www.sciencedirect.com/science/article/pii/S016041202100180X
- [11] Alimentația pacientului cu steatoză hepatică (ficat gras). (2024). Arcadia Medical. https://www.arcadiamedical.ro/medinfo/alimentatia-pacientului-cu-steatoza-hepatica-ficat-gras-sau-boala-ficatului-gras-non-alcoolic
- [12] Diet and sugary drinks raise risk of common liver disease. (2025). CNN. https://www.cnn.com/2025/10/06/health/diet-sugary-soda-fatty-liver-cancer-wellness
- [13] USA Today. (2025). Sorry soda lovers, new study has bad news for your liver. https://www.usatoday.com/story/life/health-wellness/2025/10/08/soda-diet-liver-disease-study-research/86579096007/
- [14] Lanaspa, M. A., et al. (2016). Vasopressin mediates fructose-induced metabolic syndrome and steatohepatitis. JCI Insight, 1(1), e84433. https://insight.jci.org/articles/view/140848
- [15] Zelt, J., et al. (2015). Vasopressin and hydration play a major role in the development of metabolic syndrome. PubMed. https://pubmed.ncbi.nlm.nih.gov/25622862/
- [16] Jackson, K., et al. (2018). Hydrogen-rich water reduces liver fat accumulation and improves liver enzyme profiles in patients with non-alcoholic fatty liver disease: a randomized controlled pilot study. ScienceDirect, S2210740119300853. https://www.sciencedirect.com/science/article/pii/S2210740119300853
- [17] Examine.com. (2024). Plain-water intake and all-cause mortality risk in people with NAFLD/MASLD. https://examine.com/research-feed/study/0ODAZ9/
- [18] Kim, H. S., et al. (2021). Effect of water intake on liver stiffness measurement using transient elastography. Journal of Clinical Ultrasound, 49(7), 711-716. https://pubmed.ncbi.nlm.nih.gov/33837275/
- [19] Hatori, M., et al. (2012). Time-restricted feeding without reducing caloric intake prevents metabolic diseases in mice. Cell Metabolism, 15(6), 848-860. https://pmc.ncbi.nlm.nih.gov/articles/PMC10359613/
- [20] Panda, S. (2016). Circadian rhythms and metabolism. Annual Review of Physiology, 78, 301-321. https://pmc.ncbi.nlm.nih.gov/articles/PMC10359613/
- [21] Froy, O., & Chapkin, R. S. (2016). Circadian rhythms and diet: a systematic review. Journal of Nutritional Biochemistry, 35, 1-11. https://pmc.ncbi.nlm.nih.gov/articles/PMC10359613/
- [22] Popkin, B. M., D'Anci, K. E., & Rosenberg, I. H. (2010). Water, hydration, and health. Nutrition Reviews, 68(8), 439-458. https://pubmed.ncbi.nlm.nih.gov/20647043/
- [23] Van Walleghen, M. L., et al. (2007). Effect of pre-meal water intake on the serum levels of copeptin and energy intake. Obesity (Silver Spring), 15(12), 2933-2938. https://pmc.ncbi.nlm.nih.gov/articles/PMC8212309/
- [24] Rhee, S. Y., et al. (2023). Dietary Sodium and Nonalcoholic Fatty Liver Disease. Nutrients, 15(7), 1709. https://pmc.ncbi.nlm.nih.gov/articles/PMC10045331/
- [25] Nakamura, K., et al. (2017). Vasopressin and metabolic disorders: translation from experimental models to clinical use. Journal of Internal Medicine, 282(4), 282-293. https://onlinelibrary.wiley.com/doi/10.1111/joim.12649
- [26] Andres-Hernando, A., et al. (2021). Vasopressin mediates fructose-induced metabolic syndrome by activating the V1b receptor. JCI Insight, 6(1), e140848. https://insight.jci.org/articles/view/140848
- [27] Liu, J., et al. (2025). Special correlation between diet and MASLD: positive or negative? PMC. https://pmc.ncbi.nlm.nih.gov/articles/PMC11992798/
- [28] Simancas-Racines, D., et al. (2025). Nutritional Strategies for Battling Obesity-Linked Liver Disease. PMC. https://pmc.ncbi.nlm.nih.gov/articles/PMC11724794/
- [29] Herman, M. A., & Samuel, V. T. (2021). Molecular aspects of fructose metabolism and metabolic disease. ScienceDirect, S1550413121004290. https://www.sciencedirect.com/science/article/pii/S1550413121004290
- [30] Mayo Clinic. (2025). Fatty liver disease (MASLD) diet. https://www.mayoclinic.org/diseases-conditions/nonalcoholic-fatty-liver-disease/in-depth/fatty-liver-disease-masld-diet/art-20588469
- [31] British Liver Trust. (n.d.). MASLD, NAFLD and fatty liver disease. https://britishlivertrust.org.uk/information-and-support/liver-conditions/masld-nafld-and-fatty-liver-disease/
- [32] Keating, S. E., et al. (2023). Exercise in the Management of Metabolic-Associated Fatty Liver Disease. PMC. https://pmc.ncbi.nlm.nih.gov/articles/PMC10687186/
- [33] Cleveland Clinic. (n.d.). Metabolic dysfunction-associated steatotic liver disease (MASLD). https://my.clevelandclinic.org/health/diseases/22437-non-alcoholic-fatty-liver-disease
- [34] Cuthbertson, D. J., et al. (2024). Exercise improves surrogate measures of liver histological response in metabolic dysfunction-associated steatotic liver disease. Liver International, 44(1), 115-127. https://onlinelibrary.wiley.com/doi/10.1111/liv.15947
- [35] Liu, C., & Liu, C. J. (2025). Effects of exercise intervention in subjects with metabolic dysfunction-associated steatotic liver disease. Journal of Obesity & Metabolic Syndrome, 34(1), 20-29. https://pmc.ncbi.nlm.nih.gov/articles/PMC12318708/
- [36] Souza-Tavares, H., et al. (2024). Exercise enhances hepatic mitochondrial structure and function, impeding MASLD progression. Journal of Nutritional Biochemistry, 125, 109552. https://www.sciencedirect.com/science/article/abs/pii/S0271531724000502